Son on yılda küresel ilaç pazarında yaşanan değişim sonucu pazarın yapısı kimyasal ilaçlardan biyolojik moleküllere doğru kayıyor. “Blockbuster” denilen ve tüm dünyada yüksek satış ciroları elde eden moleküllere baktığımızda kimyasal olanların giderek azaldığını görüyoruz. Sayısal açıdan kimyasal ilaçlar hala pazara hakim görünse de kutu başına değerde biyolojik ilaçlar büyük bir üstünlük sağlıyor. Biyolojik/biyoteknolojik ilaçlara olan evrilme, farmakolojik açıdan tedavisi zor hastalıkların (otoimmün hastalıklar, farklı türlerde kanserler, nörolojik ve hematolojik hastalıklar, nadir hastalıklar vb.) tedavilerinde yeni ufuklar açarken, ekonomik açıdan yüksek hatta bazen erişilmez fiyatları nedeniyle ülkelerin geri ödeme sistemlerinde ciddi bütçesel zorlanmalara neden olmaktadır. Biyoteknolojinin en çok odaklandığı kanser, otoimmün hastalıklar ve diyabet tedavileri biyolojik ürünler pazarının % 60′ ından fazlasını oluşturmaktadır. Öte yandan yüksek fiyatlar ve sağladığı cirolar özellikle çok uluslu şirketlerin ürün portföylerinin ve R&D pipeline’ larının değişmesine, hatta bu firmaların biyoteknoloji konusunda innovatif firmaları, start-up ları satın alıp bünyelerine katmalarına neden olmaktadır.
 Biyoteknolojik ilaçların ticari üretimi 80 li yılların başında insülin preparatların pazara verilmesi ile başlamış, bunu takip eden yıllarda ise sayıları giderek artmaya ve çeşitlenmeye başlamışlardır. 2016 yılında FDA tarafından onaylanan yeni moleküllerin yaklaşık yarısını biyolojik ürünler teşkil etmektedir.
Biyoteknolojik ilaçların ticari üretimi 80 li yılların başında insülin preparatların pazara verilmesi ile başlamış, bunu takip eden yıllarda ise sayıları giderek artmaya ve çeşitlenmeye başlamışlardır. 2016 yılında FDA tarafından onaylanan yeni moleküllerin yaklaşık yarısını biyolojik ürünler teşkil etmektedir.
Nitekim aşağıda Tablo 1 de görüleceği gibi 2019 yılında dünyada en fazla satan ilk 20 ilacın 13 tanesi biyolojik ilaç (12 si biyoteknolojik) iken sadece 7 tanesi kimyasaldır. Bu ürünlerin yıllık cirolarına baktığımızda ise 10.sıradaki ilacın bile Türkiye ilaç pazarının toplamından daha büyük olduğunu kolayca görebiliyoruz.
Tablo 1. 2019 yılı itibarı ile dünyada en çok satan ilk 20 ilaç
| Etkin madde | Farmasötik Kategori | Tedavi | Dünya Cirosu (Milyar $) |
| Adalimumab | Biyoteknolojik | RA (*) , AS, Crohn hast., UK, Psoriazis | 19.73 |
| Pembrolizumab | Biyoteknolojik | Melanom, çeşitli kanserler | 11.12 |
| Lenalidomid | Kimyasal | Multipl miyelom | 11.11 |
| Nivolumab | Biyoteknolojik | Melanom, çeşitli kanserler | 8.06 |
| Aflibercept | Biyoteknolojik | Maküler dejenerasyon, diyabetik retinopati, | 7.99 |
| Apixaban | Biyoteknolojik | Antikoagülan | 7.93 |
| Etanercapt | Biyoteknolojik | RA, AS, Psoriazis, | 7.23 |
| Bevacizumab | Biyoteknolojik | Çeşitli kanser türleri | 7.12 |
| Ustekinumab | Biyoteknolojik | Psoriazis, Crohn hast., UK, | 6.62 |
| Rituximab | Biyoteknolojik | Non-hogdkin lenfoma, lenfositik lösemi, RA, | 6.54 |
| Rivaroxaban | Biyoteknolojik | Antikoagülan, koroner ve periferal arter hastalığı | 6.35 |
| Transtuzumab | Biyoteknolojik | HER-2 (+) göğüs kanseri ve mide kanseri | 6.08 |
| Pneumococcal 13-valent conjugate vaccine | Biyolojik | Pnömokoksik pneumonia | 5.95 |
| İbrutinib | Kimyasal | Lenfositik lösemi, lenfoma | 5.69 |
| İnfliximab | Biyoteknolojik | Psoriazis, RA, AS, UK, Crohn hast. | 5.03 |
| Palbociclib | Kimyasal | HR (+), HER2 (-) göğüs kanseri | 4.96 |
| Bictegravir+emtricitabin +tenofovir | Kimyasal | HIV | 4.74 |
| Dimetil fumarate | Kimyasal | Multipl skleroz | 4.43 |
| Dulaglutide | Kimyasal | Tip 2 diyabet | 4.13 |
| Elvitegravir+cobicistat +emtricitabin+tenofovir | Kimyasal | HIV | 3.98 |
(*) RA : Romatoid Artrit , AS : Anklozan Spondilit, UK : Ülseratif Kolit
Ref. www.fiercepharma.com/special-report/top-20-drugs-by-global-sales-2019
Tabloda yer alan ilaçların ciroları gerçekten göz kamaştırıcı, bir o kadar da korkutucu, bu tablo istisnasız tüm ülkelerin geri ödeme sistemlerini zorlayacak bir tablo. İşte bu noktada ortaya “Biyobenzer” ilaçlar çıkıyor.
BİYOBENZERLERİN DOĞUŞU
İlaçların ruhsatlandırılması sırasında uygulanan kaideler göz önüne alındığında, bazı ülkelerin sıkı bazılarının ise gevşek regülasyonlara sahip olduğunu görüyoruz. Sıkı regülasyonlara sahip ülkelerden birisi de hiç şüphesiz Türkiye. Bu uygulamalara sahip ülkeleri “Regüle Marketler” olarak adlandırabiliriz.
Regüle marketlerde ilk biyobenzer ilaç Avrupa Birliğinde 2006 yılında ruhsatlandırıldı, yani bundan tam 15 yıl evvel. Bu ilacın adı “Somatropin” idi. Pazarın büyüklüğü ve çok uluslu firmaların bu pazarda rekabet istememeleri sonucu çok yakın zamana kadar biyobenzerler üzerinde çok fazla spekülasyonlar yapıldı. 70-80 li yıllarda eşdeğer (jenerik) ilaç pazarında çok uluslu firmaların uyguladığı baskıcı politikalar ve eşdeğer ilaçları gerek sağlık profesyonellerinin gerekse kamunun gözünde küçük düşürücü tanıtımlar, biyobenzerler içinde uygulanmaya başladı. Biyobenzerlerin referans ilaçla kesinlikle aynı olmayacağı, tedavide büyük riskler getireceği, özellikle immunojenisite yönünden çok tehlikeli sonuçlar doğuracağı gibi söylemler her ülkede ve Türkiye’de güven konusunda ciddi soru işaretlerinin ortaya çıkmasına neden oldu. Hatta bu nedenle ABD’ de ilk biyobenzer Avrupa Birliği’ nden ancak dokuz yıl sonra 2015 de FDA tarafından ruhsatlanabildi.
Aşağıdaki tablo Mart 2021 tarihi itibarı ile regüle marketlerde ruhsatlanan biyobenzer ilaçları sunuyor.
Tablo 2. Regüle marketlerde ruhsatlanmış biyobenzer ilaçlar (Mart 2021
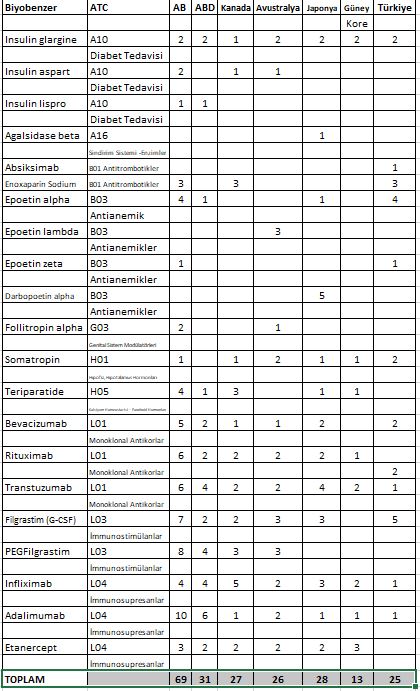
Ref. 1 :www.gabionline.net (AB, ABD, Kanada, Avustralya, Japonya, G.Kore bilgileri için) Ref. 2 : TİTCK ve İEİS kayıtları (Türkiye bilgileri için)
Tablodan da görüleceği gibi Avrupa Birliği hem diğer ülkelerden önce ilk biyobenzer ruhsatını vermiş hem de sayıca diğer ülkelerin çok üstünde biyobenzeri pazara vererek çok büyük bir deneyim ve geri ödeme sistemlerinde büyük bir kazanım sağlamıştır. ABD biyobenzerler konusunda halen beklenen atılımı yapabilmiş değildir. Ruhsatlanan 31 ürüne karşılık pazarda bulunan ürün sayısı sadece 18 dir. Avrupa Birliğinde tabloda yer alan ürünlerin tamamının pazarda bulunması biyobenzerlerle tedavide elde edilen büyük başarının sağladığı güvenin sonucudur.
Avrupa Birliğinde biyobenzer tıp politikaları üzerine ilerlemenin değerlendirildiği 29 Mart 2021 tarihli raporda sadece Avrupa Birliğinde 2006 yılından bu yana biyobenzer ilaçların kullanımı “2 milyar hasta tedavi gününe” ulaştığı belirtilmektedir.

ABD’ de uzman hekimler ve birinci basamak hekimlerinin üyesi olduğu çevrimiçi doktor platformu ve QuantiaMD topluluğu tarafından yapılan yakın tarihli bir ankette, ankete katılan doktorların % 78’i “biyobenzer” terimine aşina olduklarını söyledi, ancak reçete yazan uzmanların yalnızca % 17’si bunları reçete etme olasılığının çok yüksek olduğunu düşünüyor. Buna ek olarak, reçete yazan uzmanların sadece % 12’si biyobenzerlerin ilacın referans versiyonu kadar güvenli olduğundan “çok emindi” ve % 80’i biyobenzerler hakkında daha fazla bilgi edinmeleri gerektiğini söyledi (1). Bu anketin bir benzeri Avrupa Birliğinde yapılmış, biyobenzer terimine aşina hekim sayısının % 88.6 olduğu ve % 59 unun biyobenzerleri halen reçete ettikleri ortaya çıkmıştır (2). Bu sonuçlar ABD nin önünde daha uzun bir yol olduğunu göstermektedir.
Türkiye’deki durum ise şöyle özetlenebilir. Halen Türk İlaç Pazarında referans biyoteknolojik ve biyobenzer olarak marka bazında 141 ürün bulunmaktadır (Nisan 2021). Bu ürünlerden 116 tanesi referans biyoteknolojik üründür ve bunlar 254 form şeklinde pazardadır. Biyobenzerler ise 25 ürün ve 94 form olarak pazarda bulunmaktadır.
Biyobenzer ürünlerin 7 tanesi TİTCK kayıtlarına göre imaldir. Bunların 4 tanesi bulk olarak ithal edilip ülkemizde doldurulmaktadır (fill&finish). Diğerlerin biri biyolojik materyalden başlayarak, diğer ikisi ise hücre hattı geliştirme ve edinme yöntemi ile ilk basamaklardan başlayarak üretilmektedir (İEİS).
BİYOBENZERLERE GÜVEN NASIL OLUŞTU?
Biyobenzerlere karşı yapılan olumsuz tanıtımlar herkesin kafasında soru işaretleri oluşturuyordu. Bu konuda en cesur davranan ülkeler başta Norveç, Danimarka gibi İskandinav ülkeleri oldu.
Bu konudaki ilk Faz IV çalışma Norveç Hükumetinin sponsorluğunda yapılan NOR-SWITCH çalışması idi. 52 haftalık takip süreli bu randomize çift kör çalışmada; en az 6 ay boyunca hastane ortamında referans infliksimab ile tedavi edilen hastaların yarısına CT-P13 kodlu biyobenzer ürün verildi (switching). Veriler, Norveç’teki 40 çalışma merkezinden toplandı. Çalışmanın sonucu gerek etkinlik ve gerekse ciddi advers olaylar yönünden hiçbir istatistiksel fark ortaya koymadı (3). NOR-SWITCH çalışmasının sonuçları 18 Ekim 2016 da Birleşik Avrupa Gastroentroloji (UEG) haftasında Viyana’da açıklandı.
Bu çalışma ardından pek çok çalışmayı ateşledi. İtalya’da Prosit-Bio ve Danimarka’da DanBio, Hollanda’da Bio-Switch çalışmaları, keza İspanya ve Macaristan’da yapılan “real life” çalışmalarının hepsi olumlu sonuçlar verdi.
Bir başka önemli sonuç ise Etanercept ile ilgili. 2018 yılında yayınlanan bu çalışmada Referans etanercept ile biyobenzeri (SB4) karşılaştırıldı. Bu çaslışmanın sonucunda biyobenzer etanercept’in referans ürüne göre daha düşük immunojenisite gösterdiği ortaya koyuldu. Enjeksiyon yerinde oluşan reaksiyonlar yönünden ( kızarıklık, kaşıntı, sertleşme vb.) biyobenzer ürün % 3.7 ye karşın % 17.5 ile üstün bulunurken; immunojenisitenin işareti anti-drug antikorların (ADA) oluşumu yönünden biyobenzer ürün % 1’e karşılık % 13.4 ile üstünlük gösterdi (4).
Son olarak ta tüm bu çalışmaların özetlendiği “Current Rheumatology Reports” da yapılan 53 “switching” çalışmasında (Infliximab biyobenzerleri ile 29; Etanercept biyobenzerleri ile 4; Adalimumab biyobenzerleri ile 3; Rituximab biyobenzeri ile 1 ve diğer çalışmalar) switch yapılan gruplar ile yapılmayan gruplarda etkililik ve güvenilirlik açısından hiçbir fark ortaya çıkmazken, çalışmaların % 51 inde immunojenisite değerlendirmeleri de yapılmış ve sonuçlar tamamen benzer çıkmıştır (5). Dört-beş yılda tamamlanan bu çalışmalar ile biyobenzerlere yapılan karalamaların bilimsel olarak doğru olmadığı anlaşılmış ve güvenle kullanılmaya başlanmışlardır.
BİYOBENZERLERE DESTEK POLİTİKALARI
Avrupa Birliği ülkeleri bazen topluca ama çoğunlukla tek başlarına biyobenzerlerin bulunabilirliği, fiyatlandırma sistemleri, perakende pazarları, hastane ihaleleri, geri ödeme sistemleri, sağlık profesyonelleri ile ilgili uygulamalar ve hastalarda dahil tüm paydaşların eğitilmeleri konularında ciddi politikalar oluşturarak biyobenzerlerin yaygın kullanımı konusunda çok yol almışlardır.
Bu konuda iki farklı ülke örneğini yol gösterici olarak sunmak isterim;
- Kanada ; 2019 sonu itibarı ile dünya sıralamasında GDP yönünden 1.7 trilyon USD ve kişi başına gelirde 45.000 USD ile dünyada onuncu büyük ekonomi olan 40 miyon nüfuslu Kanada, büyük ekonomik gücüne rağmen sağlık harcamalarında akılcı davranıyor ve biyobenzerlerin kullanımını yaygınlaştırmak için kararlar alıyor. Bu amaçla en büyük eyaletlerinden Alberta, British Kolombo ve Ontario’da (Bu üç eyaletin nüfusu toplam Kanada nüfusunun % 59 u) romatoloji ve enflamatuvar barsak hastalığı hastalarında 6 ay içerisinde kullanmakta oldukları referans Etanercept ve İnfliximab’ın biyobenzerleri ile değiştirilmesi şartını devreye sokuyor ve uyguluyor.
- Bir diğer örneği İtalya’dan vermek mümkün. Referans biyoteknolojik ilaçların yüksek maliyetleri nedeniyle geri ödeme sisteminde zorluklar yaşayan İtalya, 2017’nin başında aldığı Senato kararı ile bölgesel olarak yapılan ihalelerde yeni bir uygulamayı devreye soktu. Buna göre önceden ihalesi yapılmış ve 2-3 yıl için alımına karar verilmiş referans ilacın, ihale süresince patentinin bitmesi ve bir veya daha fazla biyobenzerin pazara girmesi durumunda 60 gün içerisinde ihalenin henüz süresi dolmadan yeni bir ihale açılarak biyobenzerlerin de ihaleye dahil edilmesi sağlanacak, böylece hastanelerde daha fazla biyobenzer kullanımı teşvik edilmiş olacaktır.
Bu iki ülke örneğinde olduğu gibi ülkelerin kendi bütçe ve ihtiyaçlarına göre alacağı kararlarla biyobenzerlerin desteklenmesi adeta bir zorunluluktur. Tedavide eğilimler biyoteknolojik ilaçlara kayarken, onların ayrılmaz bir parçası olan biyobenzerlerin bulunabilirliğinin sağlanması kamunun sağlık politikaları açısından çok önemlidir. Biyobenzerlerin hızlıca devre girebilmesi için kamu otoritesinin atması gereken adımları şöyle sıralamak mümkündür;
- Hekim, eczacı ve yardımcı sağlık personelinin biyoteknolojik ve biyobenzer ilaçlara ilişkin bilgi ve farkındalık düzeyini artıracak eğitimlere önem verilmeli,
- Biyobenzerler aleyhinde yapılacak bilim dışı tanıtım ve yayınlar engellenmeli ve cezalandırılmalı,
- Regülasyonlarda ve yasada yapılacak düzenlemelerle biyobenzerlerin pazara erişimleri hızlandırılmalı, geri ödeme listelerine bekletilmeksizin girişleri sağlanmalı, özellikle yurt içinde geliştirilip üretilen biyoteknolojik ürünlerde alım garantili ihale sistemine geçilmeli,
- Biyoteknoloji konusunda nitelikli personelin yetiştirilmesi amacıyla başta Eczacılık, Tıp ve Biyoloji alanlarında lisans üstü eğitim imkanlarının artırılması ve desteklenmesi, bu eğitimler sırasında biyoteknoloji alanında ileri ülkelerin araştırma merkezlerinde burs imkanları sağlanarak teorik bilginin üzerine pratik kazanımlar eklenmesi sağlanmalıdır.

M.Vedat EĞİLMEZ
Eczacı, Farmakolog
Referanslar;
- Jennifer Fox: Biosimilars; Challenges and Barriers to Entering the U.S. Market American Pharmaceutical Review July 25, 2018
- 6 out of 10 Doctors Have Already Prescribed Biosimilar Medicines According To Europabio Paper. Brussels – 20 April 2016 : medicinesforeurope.com/news/
- gov, NCT02148640 (https://clinicaltrials.gov/)
- Etanercept biosimilar SB4 less immunogenic than Enbrel / Research / Biosimilars / Home – GaBI Online – Generics and Biosimilars Initiative
- Robert Moots et al. : Switching between referance biologics and biosimilars fort he treatment of Rheumatology, Gastraenterology and Dermatology Inflammatory Conditions: Considerations for the Clinicians. Curr. Rheumatol. Rep. 2017; 19(6): 37.




















