Sosyal Güvenlik Kurumu Başkanlığından:
SOSYAL GÜVENLİK KURUMU SAĞLIK UYGULAMA TEBLİĞİNDE
DEĞİŞİKLİK YAPILMASINA DAİR TEBLİĞ
MADDE 1 – 24/3/2013 tarihli ve 28597 sayılı Resmi Gazete’de yayımlanan Sosyal Güvenlik Kurumu Sağlık Uygulama Tebliğinin 1.8.1 numaralı maddesinin altıncı fıkrasında yer alan “Kurumca belirlenen kronik hastalıklar” ibaresinden sonra gelmek üzere “, elektronik sevk formu ile sevk edilen hastalar ” ibaresi eklenmiştir.
MADDE 2 – Aynı Tebliğin 1.9.2 numaralı maddesinin birinci fıkrasının birinci cümlesi aşağıdaki şekilde değiştirilmiştir.
“Aşağıda belirtilen kişilerden hiçbir ilave ücret alınamaz.”
MADDE 3 – Aynı Tebliğin 2.4.1.B-1 numaralı maddesinin ikinci fıkrası aşağıdaki şe-kilde değiştirilmiştir.
“(2) %40 ve üzerinde engelli kişilerin özel sağlık hizmeti sunucuları ile Kurumla söz-leşmesi olmayan resmi sağlık hizmeti sunucularındaki diş ünitelerinde yapılan diş tedavilerinin ödenebilmesi için, engellilik durumu belgelendirilmelidir. Bu hastalar; Sağlık Bakanlığına bağlı ağız ve diş sağlığı merkezleri (ADSM), ağız ve diş sağlığı hastaneleri, ağız ve diş sağlığı eğitim ve araştırma hastaneleri veya üniversitelerin diş hekimliği fakültelerince muayene yapan hekim tarafından sağlık raporu düzenlenmesi halinde, özel sağlık hizmeti sunucuları ile Kurumla söz-leşmesi olmayan resmi sağlık hizmeti sunucularındaki diş ünitelerine başvurabilirler. Sağlık raporunda, yapılacak ağız ve diş sağlığına ilişkin tedaviler açıkça belirtilmelidir. Engellilik du-rumu nedeni ile ağız ve diş muayeneleri yapılamayan hastalarda bu durum sağlık raporunda belirtilmelidir. Sağlık raporunun düzenlendiği tarihten itibaren 10 iş günü (raporun alındığı gün dahil) içinde tedaviye başlanması gerekmektedir.”
MADDE 4 – Aynı Tebliğin 2.4.4.D-1-1 numaralı maddesinin sekizinci fıkrasında yer alan “kurulu” ibaresi yürürlükten kaldırılmıştır.
MADDE 5 – Aynı Tebliğin 2.6.1.A numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) Birinci fıkrasının (a) bendi aşağıdaki şekilde değiştirilmiştir.
“a) İkinci veya üçüncü basamak sağlık hizmeti sunucusu bulunmayan ilçelerde birinci basamak resmi sağlık kuruluşu tarafından yapılan sevklere ilişkin yol gideri, en yakın ikinci basamak sağlık hizmeti sunucusunun bulunduğu yerleşim yeri,”
b) Birinci fıkrasının (b) bendinde yer alan “tedavinin yapılabildiği” ibaresi yürürlükten kaldırılmıştır.
c) İkinci fıkrasının (a) bendinin sonuna “(donör dahil)” ibaresi eklenmiştir.
ç) İkinci fıkrasının (c) bendinde yer alan “Uzuv replantasyonu” ibaresinden sonra gel-mek üzere “veya kontrolü” ibaresi eklenmiştir.
MADDE 6 – Aynı Tebliğin 2.6.1.B-3 numaralı maddesinin birinci fıkrasının (b) ben-dinde yer alan “naklin öngörülmesi durumunda da” ibaresinden sonra gelmek üzere “hastalığın ne olduğu, mutat taşıt aracı ile seyahat edememe gerekçeleri ve taşıt tipinin belirtildiği” ibaresi eklenmiştir.
MADDE 7 – Aynı Tebliğin 2.6.1.B-4 numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Dördüncü fıkrasının birinci cümlesi aşağıdaki şekilde değiştirilmiş ve ikinci cümlesi yürürlükten kaldırılmıştır.
“Tarifeli uçak için ibraz edilen bilet/fatura tutarı, ekonomi sınıf bedeli üzerinden ödenir.”
b) Beşinci fıkrasında yer alan “28 inci maddesi gereği belirlenen” ibaresinden sonra gelmek üzere “asgari” ibaresi eklenmiştir.
MADDE 8 – Aynı Tebliğin 2.6.2 numaralı maddesinin birinci fıkrasına aşağıdaki bent eklenmiştir.
“ç) Belli bir program çerçevesinde sayılan tedaviler hariç olmak üzere sevk edilen sağlık hizmeti sunucusunda ayaktan tedavinin başvuru tarihinden itibaren 10 günü aşması halinde, gerekçesinin sevk belgesinde belirtilmesi durumunda 10 günü aşan süreler için de gündelik ödenir.”
MADDE 9 – Aynı Tebliğin 2.6.3 numaralı maddesinde aşağıdaki düzenlemeler yapıl-mıştır.
a) Maddenin başlığı olan “Refakatçi giderleri” ibaresinden sonra gelmek üzere “(yol, gündelik)” ibaresi eklenmiştir.
b) Birinci fıkrasının ikinci cümlesinin başına “%40 ve üzeri engelli kişilerde, organ, doku, kök hücre nakli, uzuv replantasyonu tedavilerinde ve” ibaresi eklenmiştir.
MADDE 10 – Aynı Tebliğin 2.6.4 numaralı maddesinin birinci fıkrasının giriş ibaresi aşağıdaki şekilde değiştirilmiştir.
“Mevzuata uygun olarak yerleşim yeri dışındaki sağlık hizmeti sunucusuna sevk edilen ve sevk edildiği sağlık hizmeti sunucusunca belirli aralıklarla kontrolü uygun görülen organ, doku ve kök hücre nakli uygulanan, kanser tedavisi gören, uzuv replantasyonu yapılan veya meslek hastalıkları hastanesinde meslek hastalığı nedeniyle tedavi olan hastaların kontrol amaç-lı sevkleri;”
MADDE 11 – Aynı Tebliğin 2.6.9 numaralı maddesinin yedinci fıkrasında yer alan “Kamu Hastaneleri Birliği Genel Sekreterliğine” ibaresi “İl Sağlık Müdürlüğüne” şeklinde de-ğiştirilmiştir.
MADDE 12 – Aynı Tebliğin 3.1.2 numaralı maddesinin on dokuzuncu fıkrasında yer alan “merkezleri ile işitme cihazı” ibaresi yürürlükten kaldırılmıştır.
MADDE 13 – Aynı Tebliğin 3.3.4.A numaralı maddesinin altıncı ve yedinci fıkraları yürürlükten kaldırılmıştır.
MADDE 14 –Aynı Tebliğin 3.3.35 numaralı maddesinin on birinci fıkrasında yer alan “İşitme cihazı sağlık kurulu raporu ve” ibaresi yürürlükten kaldırılmıştır.
MADDE 15 – Aynı Tebliğin 4.1.4 numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) Birinci fıkrasının üçüncü cümlesinde yer alan “için” ibaresi “sadece ilgili uzman he-kimlerce reçete edilmesi halinde bedeli Kurumca karşılanır,” şeklinde değiştirilmiştir.
b) Beşinci fıkrasına aşağıdaki cümleler eklenmiştir.
“Topikal antifungaller bir reçetede en fazla 2 kutu yazılabilir. Tedavinin devamı gerekli ise de-vam reçetesi/reçetelerinin dermatoloji uzman hekimi tarafından düzenlenmesi halinde bedeli Kurumca karşılanır.”
MADDE 16 – Aynı Tebliğin 4.2.1.C numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) 4.2.1.C-1 numaralı alt maddesinin birinci fıkrasının (b) bendi aşağıdaki şekilde de-ğiştirilmiştir.
“b) Juvenil romatoid artritli (poliartiküler-idiyopatik-kronik) hastalarda;
1) NSAİ ve/veya methotrexat ile 3 aylık tedavi sonunda ACR pediatrik 30 yanıtı alına-mamış ise bu durumun belirtildiği 3 ay süreli sağlık kurulu raporuna dayanılarak Anti-TNF ilaçlarla tedaviye başlanabilir.
2) Adalimumabın flakon formunun yalnızca; bir veya daha fazla hastalık modifiye edici anti-romatizmal ilacı en az 3 ay kullanmış olmasına rağmen ACR pediatrik 30 yanıtı alınama-mış olan üveit eşlik eden aktif poliartiküler jüvenil idiyopatik artritli 2-17 yaşları arası çocuk ve adölesan hastalarda methotrexat ile kombine olarak tedaviye başlanılarak kullanılması ha-linde bedeli Kurumca karşılanır. Adalimumabın flakon formunun methotrexata karşı intolerans gelişmesi durumunda veya methotrexat ile tedaviye devam edilmesinin uygun olmadığı du-rumlarda monoterapi olarak kullanılması halinde bedeli Kurumca karşılanır.
3) Tedaviye başlandıktan 3 ay sonra yapılan değerlendirmede ACR pediatrik 30 yanı-tının alınması halinde, bu durumun yeni düzenlenecek 3 ay süreli sağlık kurulu raporunda be-lirtilmesi koşulu ile tedaviye devam edilir. Bu raporun süresi sonunda hastanın ACR pediatrik cevap kriteri 50 ve üzerinde olması halinde bu durumun yeni düzenlenecek 6 ay süreli sağlık kurulu raporunda belirtilmesi koşulu ile hastaların tedavisine devam edilebilir. Tedavinin de-vamında ACR pediatrik cevap kriterine 6 ayda bir bakılır, başlangıç ve ACR pediatrik cevap kriteri her sağlık kurulu raporunda belirtilir. Tedaviye rağmen ACR pediatrik cevap kriteri 50’ye ulaşmayan hastalarda anti-TNF tedavisine devam edilmez.”
b) 4.2.1.C-1 numaralı alt maddesinin onuncu fıkrasına aşağıdaki cümle eklenmiştir. “Crohn hastalığında adalimumabın flakon formunun kullanılması halinde bedeli Kurumca kar-şılanmaz.”
c) 4.2.1.C-4 numaralı alt maddesine aşağıdaki fıkra eklenmiştir.
“(2) En az 3 farklı hastalık modifiye edici antiromatizmal ilacı üçer ay süre ile uygun dozda kullanmış ve sonrasında en az bir anti-TNF ajanı 3 ay süreyle kullanmış olmasına rağmen hastalık aktivitesinin kontrol altına alınamadığı (bir ay arayla yapılmış iki ayrı muayenede en az üç hassas eklem ve en az üç şiş eklem olması) aktif psöriatik artritli yetişkin hastaların te-davisine en fazla 3 ay süreli sağlık kurulu raporuna dayanılarak tedaviye başlanır.
a) Tedaviye başlandıktan 3 ay sonra yapılan değerlendirmede yeterli cevap alınması halinde (psöriyatik artrit yanıt kriterlerine (PSARC) göre yanıt alınması), bu durumun belirtil-diği 6 ay süreli yeni düzenlenecek sağlık kurulu raporu ile tedaviye devam edilir. Yanıt alına-maması halinde tedavi sonlandırılır.
b) Bu durumların belirtildiği romatoloji uzman hekiminin yer aldığı en fazla 6 ay süreli sağlık kurulu raporuna dayanılarak, romatoloji uzman hekimleri tarafından reçete edilmesi ha-linde bedeli Kurumca karşılanır.”
MADDE 17 – Aynı Tebliğin 4.2.6.A numaralı maddesine aşağıdaki alt madde eklen-miştir.
“4.2.6.A-3- Turner sendromunda;
(1) Epifiz hatları açık olan, klinik ve genetik olarak turner sendromu tanısı almış has-talarda, en az bir çocuk endokrinoloji uzman hekiminin yer aldığı sağlık kurulu raporu ile çocuk endokrinoloji uzman hekimince reçete edilmesi halinde büyüme hormonu bedelleri Kurumca karşılanır. Rapor en fazla 1 yıl süreyle geçerli olup, raporda ilacın kullanım dozu, uygulama planı, süresi ve başlama kriterleri belirtilir.
(2) Aşağıdaki kriterlerin herhangi biri sağlandığında tedavi sonlandırılır:
a) Epifiz hattı kapandığında.
b) Yıllık büyüme hızı 4 cm. ve altında olduğunda.
c) Boy uzunluğu 155 cm.’ ye ulaştığında. ç) Kemik yaşı 14′ e ulaştığında.”
MADDE 18 – Aynı Tebliğin 4.2.9.Ç numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) Birinci fıkrasında yer alan “diyalizat kalsiyumunu 1,25 mmol/L ile kullanılmasına rağmen” ibaresi yürürlükten kaldırılmış, “>10,5” ibaresi ise “>8,5” olarak değiştirilmiştir.
b) İkinci fıkrası aşağıdaki şekilde değiştirilmiştir.
“(2) Hemodiyaliz veya periton diyaliz tedavisi altındaki hastalardan albumin ile düzel-tilmiş serum kalsiyum değeri <8,4 mg/dl olanlarda cinacalcet tedavisi kesilir.”
MADDE 19 – Aynı Tebliğin 4.2.10.B-2 numaralı alt maddesinin birinci fıkrası aşağı-daki şekilde değiştirilmiştir.
“(1) Hasta adına, en az biri çocuk metabolizma veya çocuk endokrinoloji ve metabo-lizma uzman hekimi olmak kaydıyla; gastroenteroloji veya nöroloji veya nefroloji uzman he-kimlerince düzenlenen sağlık kurulu raporuna istinaden bu hekimlerce, bu hekimlerin bulun-madığı yerlerde ise çocuk sağlığı ve hastalıkları veya iç hastalıkları uzman hekimlerince reçete edilmesi halinde bedeli Kurumca karşılanır. Raporda; teşhis, başlangıç ve devam kriter/kriterleri ile ilgili tüm bilgiler yer alır. Rapor süresi 6 aydır.”
MADDE 20 – Aynı Tebliğin 4.2.10.C-2 numaralı alt maddesinde aşağıdaki düzenle-meler yapılmıştır.
a) Birinci fıkrasının birinci cümlesinde yer alan “, nöroloji, ortopedi, fizik tedavi ve re-habilitasyon ile göğüs hastalıkları (bulunmayan yerlerde çocuk alerji ve/veya immünoloji)” ibaresi yürürlükten kaldırılmıştır.
b) İkinci fıkrasının üçüncü cümlesinde yer alan “6 aydır.” ibaresi “1 yıldır.” olarak de-ğiştirilmiştir.
MADDE 21 – Aynı Tebliğin 4.2.12.B numaralı maddesinin birinci fıkrasında aşağıdaki düzenlemeler yapılmıştır.
a) (e) bendinde yer alan “ilgili uzman hekimler” ibaresi “nöroloji uzman hekimleri” şeklinde değiştirilmiştir.
b) (f) bendinde yer alan “ilgili uzman hekimler” ibaresi “nöroloji uzman hekimleri” şeklinde değiştirilmiş, “tarafından,” ibaresinden sonra gelmek üzere “1 yıl süreyle düzenlenen uzman hekim raporuna istinaden ilgili uzman hekimlerce” ibaresi eklenmiştir.
MADDE 22 – Aynı Tebliğin 4.2.13 numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) İkinci fıkrasının ikinci cümlesi yürürlükten kaldırılmıştır.
b) 4.2.13.1 numaralı alt maddesinin yedinci fıkrası aşağıdaki şekilde değiştirilmiştir.
“(7) Kronik hepatit B tedavisinde daha önce kullanılan ilaçlar, tanı, tedaviye başlama
ve kesilme kriterleri gibi bilgilerin raporda belirtilmesi gerekmektedir.”
c) 4.2.13.1 numaralı alt maddesine aşağıdaki fıkra eklenmiştir.
“(8) Oral antiviral tedavilerde ilk rapor süresi en fazla 6 ay, sonraki rapor süreleri bir yılı geçemez.”
MADDE 23 – Aynı Tebliğin 4.2.14.C numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Birinci fıkrasında yer alan “Bevacizumab,” ibaresi yürürlükten kaldırılmıştır.
b) Üçüncü fıkrasının (n) bendine aşağıdaki alt madde eklenmiştir.
“3) Daha önceden bortezomib veya bortezomib içeren kombinasyonlarla tedavisi ba-şarısız olan nüks veya dirençli mantle hücreli lenfoma tedavisinde, bu durumların belirtildiği hematoloji ve/veya onkoloji uzmanının yer aldığı 3 ay süreli sağlık kurulu raporuna dayanılarak yine bu hekimler tarafından reçete edilmesi halinde progresyon gelişene kadar Kurumca bedeli karşılanır.”
c) Üçüncü fıkrasına aşağıdaki bentler eklenmiştir.
“nn) Bevasizumab;
1) Metastatik kolorektal kanser tedavisinde;
a) 5-florourasil/folinik asit veya 5-florourasil/folinik asit/irinotekan ile kombine olarak
metastatik kolon veya metastatik rektum kanserinin birinci basamak tedavisinde kullanılması halinde bedeli Kurumca karşılanır.
b) Daha önceki basamaklarda bevasizumabın kullanılmadığı metastatik kolon veya me- tastatik rektum kanserinin ikinci ve sonraki basamak tedavilerinde 5-florourasil/folinik asit veya 5-florourasil/folinik asit/irinotekan ile kombine olarak kullanılması halinde bedeli Ku- rumca karşılanır.
c) Daha önce adjuvant amaçlı kemoterapi almamış olan metastatik kolon veya metastatik rektum kanserli hastalarda, birinci basamak tedavi olarak okzaliplatin ile kapesitabin veya 5-florourasil/folinik asit ile kombine olarak kullanılması halinde bedeli Kurumca karşılanır.
2) Malign glioma (DSÖ evre IV)-glioblastoma tedavisinde; histolojik olarak glioblastoma multiforme tanısı almış ve bir seri temozolomid sonrası nüks gelişmiş veya progresyon gös-termiş hastalarda kemoterapi ile birlikte progresyona kadar kullanılması halinde bedeli Ku- rumca karşılanır. Bu tedavi ile progresyon gelişen hastalarda kullanılması halinde bedeli Ku- rumca karşılanmaz.
3) Serviks kanseri tedavisinde; lokal tedavilere uygun olmayan rekürren/persistan veya metastatik serviks kanseri olan erişkin hastaların birinci basamak tedavisinde paklitaksel ve cisplatin veya paklitaksel ve topotekan ile kombine olarak progresyona kadar kullanılması ha-linde bedeli Kurumca karşılanır. Daha önce radyo duyarlaştırıcı haricinde sistemik kemoterapi tedavisi almış ve progresyon göstermiş hastalarda kullanılması halinde bedeli Kurumca karşı-lanmaz.
4) Tıbbi onkoloji uzman hekiminin yer aldığı sağlık kurulu raporu ile bu sağlık kurulu raporuna dayanılarak ikinci ve üçüncü basamak sağlık kurumlarında tüm uzman hekimlerce reçete edilir.
oo) Pleriksafor;
1) Otolog kök hücre nakli gerçekleştirmek istenen lenfoma veya multipl miyelom tanısı konmuş ve aşağıdaki tedavi protokolleri ile yeterli kök hücre mobilizasyonu (>2 x 106/kg CD34 pozitif hücre) sağlanamayan erişkin hastalarda Granülosit Koloni Uyarıcı Faktör (G-CSF) ile kombine olarak kullanılır.
a) Sadece G-CSF mobilizasyonunun yeterli olacağı öngörülen hastalardan en az bir seri 10 mikrogram/kilogram gün dozunda G-CSF uygulaması ve en az bir seri G-CSF ile birlikte kemoterapi uygulaması,
b) Sadece G-CSF ile yeterli düzeyde kök hücre mobilizasyonu sağlanamayacağı öngö-rülen hastalarda en az bir seri G-CSF ile birlikte kemoterapi uygulaması.
2) Bünyesinde terapötik aferez merkezi bulunan sağlık hizmeti sunucularında, bu du-rumların belirtildiği en az biri hematoloji uzman hekimi olmak üzere hematoloji ve onkoloji uzman hekimlerinden oluşan 1 ay süreli sağlık kurulu raporuna dayanılarak hematoloji veya onkoloji uzman hekimleri tarafından en fazla 4 günlük dozda reçete edilmesi halinde bedeli Kurumca karşılanır.
öö) Denosumab 120 mg;
1) Daha önce zoledronik asit kullanmamış, kırık veya bası riski yüksek kemiklere metastaz yapmış meme kanseri, hormon refrakter prostat kanseri veya küçük hücreli dışı ak-ciğer kanseri hastalarında kemik progresyonuna kadar, en az bir tıbbi onkoloji uzman hekiminin yer aldığı 6 ay süreli sağlık kurulu raporuna dayanılarak tıbbi onkoloji uzman hekimlerince reçetelenmesi halinde bedeli Kurumca karşılanır.
2) Rezeke edilemeyen veya cerrahi morbidite riski yüksek, yetişkinler ile iskeleti ol-gunlaşmış adölesanlarda görülen kemiğin dev hücreli tümörünün tedavisinde en az bir tıbbi onkoloji uzman hekiminin yer aldığı 6 ay süreli sağlık kurulu raporuna dayanılarak tıbbi on-koloji uzman hekimlerince reçetelenmesi halinde bedeli Kurumca karşılanır.
pp) Nivolumab yalnızca;
1) ECOG performans skoru 0-1 olan, birinci basamak kemoterapi sonrasında progres- yon göstermiş, daha önce PD-1 ve PD-L1 inhibitör tedavisi almamış rezeke edilemeyen lokal ileri evre veya metastatik malign melanomu olan hastaların tedavisinde progresyona kadar tek başına kullanılır. Bu durumların belirtildiği, en az bir tıbbi onkoloji uzman hekiminin yer aldığı tedavi protokolünü de gösterir 6 ay süreli sağlık kurulu raporuna dayanılarak tıbbi onkoloji uz-man hekimlerince reçete edilmesi halinde bedeli ödenir. Tedavinin devamı için düzenlenecek sağlık kurulu raporunda hastalıkta progresyon olmadığı belirtilmelidir. İpilimumab etken mad- deli ilaç ile ardışık veya kombine kullanılması halinde bedeli ödenmez.
2) Karnofsky performans statüsü en az 70 olan, daha önce en az bir basamak sitokin (interferon veya interlökin) ve sonrasında bir basamak da antianjiojenik tedavi almış olmak şartı ile 3. veya 4. basamak tedavi olarak, ileri evre berrak hücreli renal kanser tedavisinde progresyona kadar kullanılır. Bu durumların belirtildiği, en az bir tıbbi onkoloji uzman heki-minin yer aldığı tedavi protokolünü de gösterir 6 ay süreli sağlık kurulu raporuna dayanılarak tıbbi onkoloji uzman hekimlerince reçete edilmesi halinde bedeli ödenir. Tedavinin devamı için düzenlenecek sağlık kurulu raporunda hastalıkta progresyon olmadığı belirtilmelidir.
3) Sağlık Bakanlığından hasta bazında alınacak endikasyon dışı onaya dayanılarak kla-sik hodgkin lenfoma endikasyonunda, otolog kök hücre nakli sonrasında brentuksimab tedavisi ile progresyon gösteren veya relaps olan hastalarda kullanılır. Bu durumların belirtildiği, en az bir tıbbi onkoloji veya hematoloji uzman hekiminin yer aldığı tedavi protokolünü de gösterir 6 ay süreli sağlık kurulu raporuna dayanılarak tıbbi onkoloji veya hematoloji uzman hekimleri tarafından reçete edilmesi halinde bedeli ödenir.”
MADDE 24 – Aynı Tebliğin 4.2.16 numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) Beşinci fıkrası aşağıdaki şekilde değiştirilmiştir.
“(5) İki yaşına kadar inek sütü ve/veya çoklu gıda protein alerjisi olan bebeklere önce-likle ileri derecede hidrolize mamalar başlanır. İleri derecede hidrolize mamanın tolere edile-mediği durumlarda, anafilakside, enteropatide, eozinofilik özofajitte, besin protein ilişkili enterokolit sendromunda veya çoklu besin alerjileri gibi ağır vakalarda aminoasit bazlı veya pirinç proteini bazlı mamalar kullanılır. Bu durumların belirtildiği; çocuk gastroenteroloji veya çocuk immünoloji ve alerji hastalıkları uzman hekimlerince, bu uzman hekimlerin bulunmadığı hastanelerde çocuk sağlığı ve hastalıkları uzman hekimlerince düzenlenecek uzman hekim ra-poruna dayanılarak tüm hekimler tarafından reçete edilmesi halinde bedeli Kurumca karşıla-nır.”
b) Altıncı fıkrasının birinci cümlesinde yer alan “1” ibaresi “3” olarak değiştirilmiştir.
MADDE 25 – Aynı Tebliğin 4.2.17.A numaralı maddesinde aşağıdaki düzenlemeler yapılmıştır.
a) Birinci fıkrasının üçüncü cümlesinde yer alan “1” ibaresi “2” olarak değiştirilmiştir.
b) İkinci fıkrasının birinci cümlesinde yer alan “bir” ibaresi “iki” olarak değiştirilmiştir.
MADDE 26 – Aynı Tebliğin 4.2.23 numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) Birinci fıkrası yürürlükten kaldırılmıştır.
b) İkinci fıkrası aşağıdaki şekilde değiştirilmiştir.
“(2) Bu maddede belirtilen etken maddeli ilaçların sistemik mantar enfeksiyonları te-davisinde kullanılması halinde bedelleri Kurumca karşılanır.”
c) Dördüncü fıkrasının (a) bendinde yer alan “(Yukarıda yer alan birinci ve ikinci fıkra hükümleri aranmaz.)” ibaresi yürürlükten kaldırılmış, aynı bende “Posakonazolün parenteral formları yalnızca oral formlarını kullanamayan hastalarda kullanılabilir.” ibaresi eklenmiştir.
ç) Altıncı fıkrası aşağıdaki şekilde değiştirilmiştir.
“(6) Mikafungin;
1) İnvaziv kandidiyazis ve özofajiyal kandidiyazis endikasyonlarında kullanılır.
2) Allojenik hematopoietik kök hücre nakli (HSCT) yapılan hastalarda veya akut len- fositer lösemi (ALL) hastalarında nötropenik dönemde ve takip eden bir hafta içinde veya mu- koziti olan otolog hematopoietik kök hücre nakli yapılan hastalarda nötropenik dönemde as- pergilloz ve candida enfeksiyonlarının profilaksisinde kullanılır.
3) 10 gün veya daha uzun süreyle nötropeni olması beklenen diğer hastalarda aspergil- loz ve candida enfeksiyonlarının profilaksisi endikasyonunda ödenmez.”
d) Aynı maddeye aşağıdaki fıkra eklenmiştir.
“(8) Vorikonazol 200 mg tablet; nötropeni olması beklenen hematopoietik kök hücre nakli alıcısı hastaların aspergilloz ve candida enfeksiyonlarının profilaksi endikasyonunda da kullanılır.”
MADDE 27 – Aynı Tebliğin 4.2.29 numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) Birinci fıkrasında yer alan “Bu grup ilaçların” ibaresinden sonra gelmek üzere “(aşa-ğıda belirtilenler hariç)” ibaresi eklenmiştir.
b) Aynı maddeye aşağıda yer alan fıkralar eklenmiştir.
“(2) Tek başına dienogest etkin maddesi içeren ilaçlar kadın hastalıkları ve doğum uz-man hekimlerince veya bu uzman hekimler tarafından düzenlenen uzman hekim raporuna da-yanılarak tüm hekimlerce reçete edilmesi halinde bedeli Kurumca karşılanır.
(3) Tek başına progesteron etkin maddesi içeren ve infertilite tedavisi endikasyonu olan topikal ilaçlar kadın hastalıkları ve doğum uzman hekimlerince veya bu hekimlerce düzenlenen prospektüs endikasyonlarıyla uyumlu uzman hekim raporuna istinaden diğer hekimlerce reçete edilmesi halinde bedeli Kurumca karşılanır.”
MADDE 28 – Aynı Tebliğin 4.2.38 numaralı maddesinde aşağıdaki düzenlemeler ya-pılmıştır.
a) Dördüncü fıkrası aşağıdaki şekilde değiştirilmiştir.
“(4) DPP-4 antagonistleri (sitagliptin, vildagliptin, saksagliptin, linagliptin, alogliptin), DPP-4 antagonistlerinin diğer oral antidiyabetiklerle kombine preperatları; metformin ve/veya sülfonilürelerin maksimum tolere edilebilir dozlarında yeterli glisemik kontrol sağlanamamış hastalarda; endokrinoloji uzman hekimleri ile iç hastalıkları uzman hekimlerince veya bu hekimlerce düzenlenen uzman hekim raporu ile tüm hekimlerce reçete edilebilir. Saksagliptini tek başına içeren 2,5 mg.’lık formları günlük en fazla 2,5 mg. dozunda, alogliptini tek başına içeren 12,5 mg.’lık formları günlük en fazla 12,5 mg. dozunda yalnızca kronik böbrek yetmez-liği hastalarında kullanılabilir.”
b) Aynı maddeye aşağıdaki fıkra eklenmiştir.
“(6) Sodyum-glukoz ko-transporter 2 (SGLT2) inhibitörleri (dapagliflozin, empaglif- lozin); metformin ve/veya sülfonilürelerin maksimum tolere edilebilir dozlarında yeterli gli- semik kontrol sağlanamamış hastalarda, endokrinoloji uzman hekimlerince düzenlenen uzman hekim raporu ile tüm hekimlerce reçete edilebilir.”
MADDE 29 – Aynı Tebliğin 4.4.1 numaralı maddesi aşağıdaki şekilde değiştirilmiştir.
“4.4.1 – Uygulanacak indirim oranları
(1) Depocuya satış fiyatı 4,86 (dört virgül seksen altı) TL ve altında olan ilaçlar için kamu kurum iskontosu uygulanmaz (özel iskontolar saklı kalmak kaydıyla).
(2) Depocuya satış fiyatı 4,87 (dört virgül seksen yedi) TL’nin (dahil) üzerinde olan ilaçlara kamu kurum iskontosu olarak %10 veya %11 baz iskonto uygulanır.
(3) Aşağıdaki fıkralarda konu edilen kamu kurum iskontoları ve ilave iskonto uygula-malarında ilaçların orjinal, jenerik, yirmi yıllık gibi durumlarının belirlenmesinde Sağlık Ba-kanlığı tarafından yapılmış olan düzenlemeler esas alınır. İlaçlarda oluşabilecek durum deği-şikliklerine ilişkin iskonto uygulamaları Kurum tarafından değerlendirilir.
(4) 20 yıllık ilaçlardan;
a) Depocuya satış fiyatı 4,87 (dört virgül seksen yedi) TL (dahil) ile 9,30 (dokuz virgül otuz) TL (dahil) arasında olan ilaçlara; %0 iskonto uygulanır.
b) Depocuya satış fiyatı 9,31 (dokuz virgül otuz bir) TL (dahil) ile 14,01 (on dört virgül sıfır bir) TL (dahil) arasında olan ilaçlara; %10 baz iskonto uygulanır.
c) Depocuya satış fiyatı 14,02 (on dört virgül sıfır iki) TL ve üzerinde olan, referansı olan ve referansı olmayıp imalat kartına göre fiyat alan ilaçlara; %28 iskonto (baz iskonto %11 + %17 ilave iskonto) uygulanır.
ç) Depocuya satış fiyatı 14,02 (on dört virgül sıfır iki) TL ve üzerinde olan, referansı olmayan ilaçlara; referans fiyat alana kadar %40 iskonto (baz iskonto %11 + %29 ilave iskonto) uygulanır.
(5) Jeneriği olmayan orjinal ilaçlardan;
a) Depocuya satış fiyatı 4,87 (dört virgül seksen yedi) TL (dahil) ile 9,30 (dokuz virgül otuz) TL (dahil) arasında olan ilaçlara; %10 baz iskonto uygulanır.
b) Depocuya satış fiyatı 9,31 (dokuz virgül otuz bir) TL (dahil) ile 14,01 (on dört virgül sıfır bir) TL (dahil) arasında olan ilaçlara; %31 (baz iskonto %11 + %20 ilave iskonto) iskonto uygulanır.
c) Depocuya satış fiyatı 14,02 (on dört virgül sıfır iki) TL ve üzerinde olan ilaçlara; %41 iskonto (baz iskonto %11 + %30 ilave iskonto) uygulanır.
(6) Jeneriği olan orjinal ilaçlar ile jenerik ilaçlardan;
a) Depocuya satış fiyatı 4,87 (dört virgül seksen yedi) TL (dahil) ile 9,30 (dokuz virgül otuz) (dahil) arasında olan ilaçlara; %10 baz iskonto uygulanır.
b) Depocuya satış fiyatı 9,31 (dokuz virgül otuz bir) TL (dahil) ile 14,01 (on dört virgül sıfır bir) TL (dahil) arasında olan ilaçlara; %18 iskonto (baz iskonto %11 + % 7 ilave iskonto) uygulanır.
c) Depocuya satış fiyatı 14,02 (on dört virgül sıfır iki) TL ve üzerinde olan ilaçlara; %28 iskonto (baz iskonto %11 + %17 ilave iskonto) uygulanır.
(7) Depocuya satış fiyatı 4,87 (dört virgül seksen yedi) TL ve üzerinde olan kan ürünleri, tıbbi mamalar ve radyofarmasötik ürünlere; %11 baz iskonto uygulanır.
(8) Enteral beslenme ürünlerinden;
a) Depocuya satış fiyatı 4,87 (dört virgül seksen yedi) TL (dahil) ile 9,30 (dokuz virgül otuz) TL (dahil) arasında olan ilaçlara; %11 baz iskonto uygulanır.
b) Depocuya satış fiyatı 9,31 (dokuz virgül otuz bir) TL (dahil) ile 14,01 (on dört virgül sıfır bir) TL (dahil) arasında olan ilaçlara; %21 (baz iskonto %11 + %10 ilave iskonto) iskonto uygulanır.
c) Depocuya satış fiyatı 14,02 (on dört virgül sıfır iki) TL ve üzerinde olan ilaçlara; %28 iskonto (baz iskonto %11 + %17 ilave iskonto) uygulanır.”
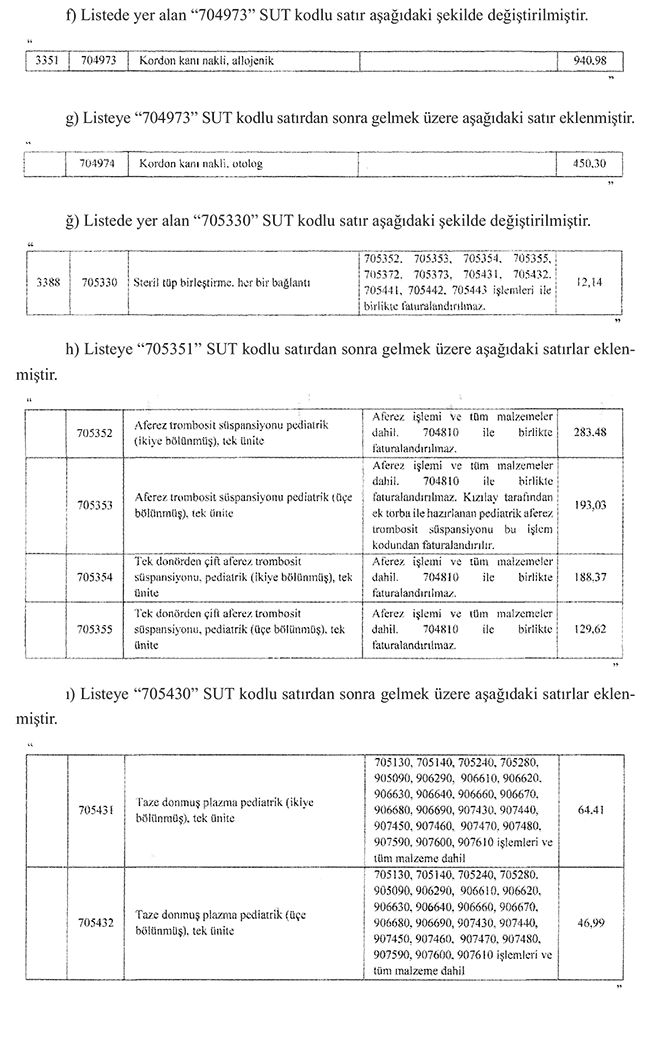
MADDE 30 – Aynı Tebliğ eki “Hizmet Başı İşlem Puan Listesi (EK-2/B)” nde aşağı-daki düzenlemeler yapılmıştır.
a) Listede yer alan “602290” SUT kodlu satır aşağıdaki şekilde değiştirilmiştir.